Ученые обнаружили сеть мозга, которая отвечает за заикание
Международная исследовательская группа выявила вероятную причину заикания в мозге
Заикание характеризуется возникновением повторов звуков и слогов, удлинений и прерываний речи. Сопутствующее поведение (например, гримасы лица, социофобия, избегание слов) и негативные эмоции и установки (например, социальная тревожность) также являются важными компонентами заикания [1] , [2] и могут оказывать глубокое негативное влияние на жизнь людей. [3] Поведенческая терапия может помочь, но результаты как правило недолговременные [4] , и в настоящее время не существует эффективных фармакологических [5] или нейромодуляционных [6] вариантов лечения заикания, которые бы помогали любому человеку с заиканием на 100%.
Наиболее типичной формой заикания является заикание, появляющееся во время развития ребенка, в младшем дошкольном возрасте, которое встречается у 5–11 % дошкольников и сохраняется во взрослом возрасте более чем у 1 % населения. [7] , [8] Большое количество исследований нейровизуализации изучало заикание, связанное с развитием, но результаты были в значительной степени противоречивыми, а нейроанатомическая основа заикания по большей части остается не ло конца ясной неясной. [9] Например, исследования сообщали об аномалиях в кортикальных двигательных, соматосенсорных и слуховых областях, передней поясной извилине, лобной покрышке, базальных ганглиях и мозжечке, среди прочих областей, без четкой конвергенции. [10-12]
Заикание и нарушение плавности речи также могут возникать после приобретенных травм или иных заболеваний головного мозга у людей, которые ранее говорили без явного заикания. Инсульт является наиболее распространенной причиной приобретенного нейрогенного заикания, составляя половину зарегистрированных случаев в литературе. [13] В исследовании, посвященном частоте приобретенного заикания после инсульта, 5% пациентов соответствовали критериям диагностики нейрогенного заикания. [14] Люди с приобретенным нейрогенным заиканием могут также проявлять сопутствующее поведение, такое как сжимание кулаков и избегание слов, а также отрицательные эмоции, такие как фрустрация. [13] Изучение очаговых поражений мозга может установить причинно-следственную нейроповеденческую связь — связь между повреждением мозга и конкретными симптомами. [15] , [16] Однако поражения, вызывающие приобретенное нейрогенное заикание, возникают в крайне неоднородных областях мозга, что оставляет его локализацию неясной. [17] , [18]
Недавно разработанный метод, картирование сети поражений, расширяет использование информации о местоположении очаговых поражений мозга путем изучения сетевых связей, общих для группы поражений. [15] , [19] Картирование сети поражений успешно применялось для локализации множественных симптомов и признаков, [15] , [20] включая двигательные расстройства, [21-25] нейропсихиатрические расстройства, [26-28] сознание [29] , [30] и другие поведенческие изменения. [31] , [32] Важно отметить, что сети, идентифицированные с помощью картирования сети поражений, по-видимому, последовательно обобщаются по первичным расстройствам мозга, вызывающим схожие симптомы, что предполагает общий нейронный субстрат для симптома, несмотря на различную этиологию. [21] , [23] Наконец, было показано, что исследование связности поражений позволяет определить эффективные цели нейрохирургического лечения, что предполагает релевантность для лечения. [23] , [24] , [33]
Нашей первой целью было проверить, связаны ли поражения мозга, вызывающие приобретенное нейрогенное заикание, с общей мозговой сетью, которая могла бы дать представление о нейронных субстратах заикания. Для этого мы применили картирование сети поражений к двум независимым наборам данных приобретенного нейрогенного заикания после инсульта. Мы предположили, что результаты картирования сети поражений в обоих наборах данных приобретенного нейрогенного заикания будут сходиться в схожих областях мозга, что приведет к общей сети нейрогенного заикания. Нашей второй целью было проверить, может ли идентифицированная приобретенная нейрогенная сеть заикания быть релевантной для всех этиологий заикания. Мы предположили, что в третьей независимой когорте, состоящей из взрослых с устойчивым заиканием развития, тяжесть заикания будет связана со структурными изменениями серого вещества в пределах идентифицированной сети нейрогенного заикания.
Заикание локализуется в одной и той же сети мозга независимо от его причины
Исследователи из Финляндии, Новой Зеландии, США и Канады разработали новый исследовательский проект, который может предоставить решение этой проблемы. В исследование были включены люди, перенесшие инсульт, у некоторых из которых сразу после него развилось заикание. Исследователи обнаружили, что хотя инсульты были локализованы в разных частях мозга, все они локализовались в одной и той же мозговой сети, в отличие от инсультов, которые не вызывали заикания.
Помимо людей, перенесших инсульт, исследователи использовали магнитно-резонансную томографию (МРТ) для сканирования мозга 20 человек с психогенным заиканием. У этих людей заикание было связано со структурными изменениями в узлах мозговой сети, первоначально выявленными в связи с поражениями, вызванными инсультом, — чем больше изменения, тем тяжелее заикание. Это открытие предполагает, что заикание вызвано общей мозговой сетью, независимо от этиологии (развития или неврологической).
Ключевыми узлами сети, выявленными исследователями, стали скорлупа, миндалевидное тело и ограда, расположенные глубоко в мозге, а также связи между ними.
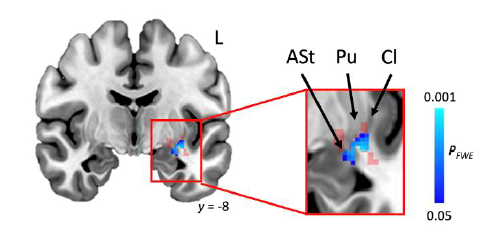
Красный: центральные узлы мозговой сети, выявленные на основе поражений при инсульте, вызывающих заикание Синий: структурные изменения, коррелирующие с тяжестью стойкого заикания, связанного с развитием. ASt = зона перехода миндалевидного тела. Pu = (Putamen) скорлупа. Cl = (Claustrum) ограда.
«Эти результаты объясняют хорошо известные особенности заикания, такие как двигательные трудности при воспроизведении речи и значительная изменчивость степени заикания в зависимости от эмоциональных состояний. Будучи основными ядрами мозга, скорлупа регулирует двигательную функцию, а миндалевидное тело регулирует эмоции. Ограда, в свою очередь, действует как узел для нескольких мозговых сетей и передает информацию между ними», — объясняет Йоутса.
Результаты исследования дают уникальное представление о нейробиологической основе заикания. Локализация заикания в мозге открывает новые возможности для медицинского лечения. Исследователи надеются, что в будущем заикание можно будет эффективно лечить, например, с помощью стимуляции мозга, которая может быть направлена конкретно на идентифицированную сейчас мозговую сеть.
Обсуждение
Это исследование выявило несколько важных результатов. Во-первых, хотя поражения, вызывающие приобретенное заикание, описанные в литературе, возникали в гетерогенных местах, они были связаны с общей мозговой сетью, сосредоточенной вокруг скорлупы. Во-вторых, эта сеть заикания была воспроизводима в независимой клинической когорте с заиканием, вызванным повреждением, и была показана как специфичная для заикания по сравнению с другими изменениями коммуникации после инсульта. Наконец, у взрослых с постоянным заиканием в процессе развития объемы серого вещества в пределах выявленной общей нейрогенной сети связей заикания были связаны с влиянием заикания, подтверждая участие постеровентральной скорлупы, постеровентральной ограды и переходной области миндалино-стриарной системы в левом полушарии в заикании в процессе развития.
Общий нейроанатомический субстрат заикания, связанного с развитием, и приобретенного заикания. Предыдущие исследования сообщали о параллелях в поведенческих характеристиках (т. е. заикание, нарушение плавности речи, связанное с ним неречевое и негативное аффективное поведение) между приобретенным нейрогенным и стойким развивающимся заиканием. [13] Текущее исследование предоставляет доказательства сходства между этиологиями заикания на нейроанатомическом уровне, показывая, что в общей приобретенной нейрогенной сети заикания структурные различия мозга у взрослых с стойким развивающимся заиканием были связаны с самоотчетным влиянием заикания. Однако такой связи не наблюдалось с частотой возникновения заикания, измеренной клиницистом. Одним из возможных объяснений может быть то, что, хотя частота заикания может быть использована для определения наличия заикания, она может быть недостаточным показателем степени нейроанатомических различий между людьми, которые заикаются, учитывая множество факторов, которые могут влиять на частоту заикания, таких как присущая временная изменчивость частоты заикания, использование поведения преодоления и избегания и навыки повышения беглости речи, приобретенные во время лечения.
Поскольку такие показатели, как OASES, можно рассматривать как совокупность тяжести испытываемых нарушений речи и их влияния на человека, эта широкая оценка может лучше отражать нейроанатомические вариации, связанные с заиканием.
Скорлупа (Putamen) как основной нейроанатомический субстрат
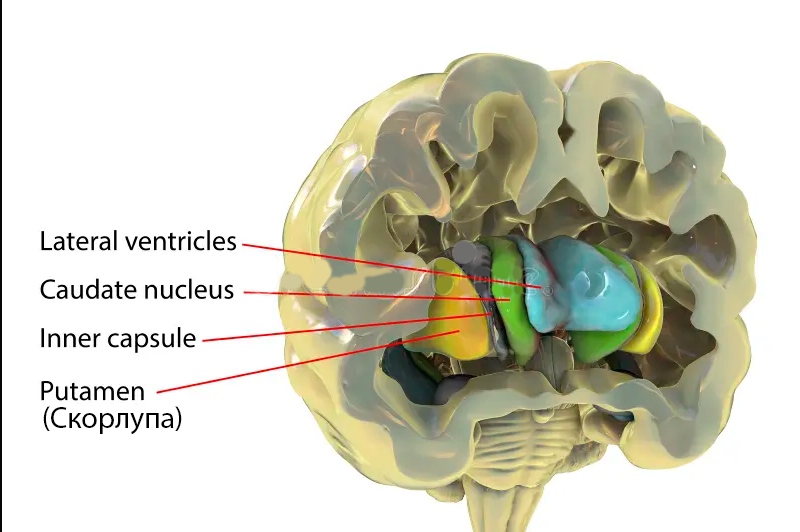
Теоретические обоснования, предполагающие причинную роль базальных ганглиев в заикании , были сформулированы ранее, [34] но не имеют исчерпывающих прямых доказательств[50]. Наше исследование подтверждает важную роль скорлупы в заикании и расширяет предыдущие теории, предполагая, что именно задне-вентральная часть скорлупы может быть ключевым узлом в расширенной сети.
Скорлупа, как правило, отвечает за внутреннюю синхронизацию и последовательность сложных двигательных движений интегрированным образом. [51] Она организована соматотопически, при этом задняя область, выявленная в нашем исследовании, известна как ответственная за двигательную регуляцию области лица, включая движения губ. [52] , [53] Было высказано предположение, что дефицит внутренних сетей синхронизации приводит к заиканию в процессе развития, на основании наблюдений, таких как уменьшение нарушений заикающейся речи во время состояний, вызывающих беглость (например, пение и ритмичная речь). [49] , [54] В то время как эти теории были сосредоточены на вовлечении более широких сетей, включая базальные ганглии и дополнительную двигательную область в заикание, наши результаты показывают, что определенное изменение в левой задней функции скорлупы может быть ключевым фактором различий во внутренних сетях синхронизации.
Кроме того, левая задняя скорлупа демонстрирует профиль реакции, который связан с привыканием и обучением у людей. [55] , [56] Это согласуется с наблюдениями, что заикание, связанное с развитием, обычно начинается в дошкольном возрасте в периоды быстрого развития, когда производство речи должно стать более автоматизированным, чтобы справиться с ростом языка. [57] Результаты исследований изменений, вызванных лечением у взрослых с устойчивым заиканием, связанным с развитием, еще раз подтверждают ключевую роль скорлупы, поскольку эта область, как постоянно сообщается, поддается успешному поведенческому лечению заикания. [58-60]
В нашей когорте взрослых с устойчивым заиканием в процессе развития увеличение объема серого вещества в левой задней части скорлупы было связано с более серьезным влиянием заикания. Аналогичное увеличение объема серого вещества в левой скорлупе ранее было выявлено у взрослых с устойчивым заиканием в процессе развития, что подтверждает наши выводы. [61] Однако дети с заиканием в процессе развития, по-видимому, имеют уменьшенный объем скорлупы. [62] Ранее сообщалось о контрастных результатах между детьми и взрослыми с заиканием в процессе развития, и они могут быть связаны с расходящимися траекториями развития мозга между детьми, которые позже выздоравливают от заикания, по сравнению с теми, чье заикание сохраняется во взрослом возрасте. [63-65] Картирование траекторий развития объема серого вещества, особенно в постеровентральной части левой скорлупы, является важным направлением для будущих исследований.
Наши выводы также подтверждаются наблюдениями за пациентами с заиканием, возникшим после других приобретенных неврологических этиологий. Например, у 7 из 10 пациентов в исследовании приобретенного заикания после проникающих травм мозга были выявлены поражения чечевицеобразных ядер (скорлупы и бледного шара). [66] Кроме того, известно, что эти регионы поражаются при паркинсонизме, [23] , [55] , [67] что может объяснить высокую (до 60%) [13] распространенность нейрогенного заикания после начала болезни Паркинсона. Интересно, что сообщалось о том, что глубокая стимуляция мозга в области бледного шара (GPi) при болезни Паркинсона вызывает новое заикание, [68] что предоставляет дополнительные доказательства причинной роли двигательных цепей базальных ганглиев в заикании и предполагает актуальность наших результатов для лечения нейромодуляцией.
В совокупности эти наблюдения за вовлечением скорлупы позволяют предположить, что недостатки в автоматизации внутренних механизмов синхронизации для последовательности сложных двигательных движений артикуляторов могут приводить к нарушениям речи как при приобретенном нейрогенном, так и при развивающемся заикании.
В дополнение к постеровентральной скорлупе наши анализы выявили участие ограды и переходной области миндалины и стриатума во всех трех независимых наборах данных. Ограда обычно не сообщается как отдельная область в исследованиях и моделях производства речи, и ее функция все еще плохо изучена. [69-71] Однако наши результаты включали ограду, которая четко дифференцирована от скорлупы и островковых областей. Ограда имеет обширные связи с корковыми и подкорковыми областями мозга и, как предполагалось, интегрирует сенсорную информацию и играет роль в нейронном гомеостазе. [72] В речи новые данные свидетельствуют о ее участии в планировании движений, а также в исполнении, в том числе в координации движений в артикуляционных подсистемах. [73] Клауструм также играет роль в социальном наказании у людей [74] и в контроле реакций, связанных с тревогой, у мышей [75] , что позволяет предположить, что положительная связь между влиянием заикания и объемом серого вещества в нашей когорте с устойчивым заиканием в процессе развития может отражать как двигательные, так и связанные с ними эмоциональные последствия заикания.
На сегодняшний день ограда не считается важной для заикания, несмотря на два предыдущих исследования, сообщавших о положительной связи между активацией ограды и тяжестью заикания в период развития. [76 , 77] Следует отметить, что в одном из исследований лечения, сообщающем об изменениях скорлупы, был отмечен кластерный пик в левой ограде, при этом повышенная активация ограды до лечения нормализовалась у тех, кто успешно завершил лечение. [58] Поскольку ограда является очень маленькой структурой — ее максимальная толщина составляет всего несколько миллиметров [72] — в будущих исследованиях следует рассмотреть возможность принятия априорных решений о включении ее в качестве области интереса в свои анализы и дальнейшей оценке ее вклада в изменения речевой моторики и связанное с этим аффективное поведение при заикании.
Значимые левосторонние результаты во всех трех наборах данных также распространились на область амигдалостриатного перехода. Как небольшая структура, расположенная между постеровентральной скорлупой и миндалевидным телом, она идеально подходит для оценки угроз и обеспечения двигательных реакций на эти угрозы. 78 Недавнее исследование на мышах показало, что ее нейронная активность отвечает за управление замиранием и поведением избегания, [78] показывая прямую связь с заиканием, поскольку и замирание, например, речевые блоки, и избегание речи являются ключевыми компонентами заикания. [1 , 2]
Клинически значимые приобретенные области сети заикания, которые показали связь с устойчивым заиканием развития, были выявлены, когда тяжесть заикания оценивалась с точки зрения говорящего, принимая во внимание все компоненты заикания. Отсутствие значимых результатов, основанных только на наблюдаемых нарушениях речи, подчеркивает важность также учета опыта говорящего, включая социально-эмоциональные реакции, при оценке и лечении заикания. Фактически, возможно, что выявленные области мозга в первую очередь связаны с несколькими факторами, способствующими самовоспринимаемому влиянию заикания развития. Поэтому лечение, нацеленное на эти области, может иметь более широкое влияние на заикание, например, уменьшая тревожность и смягчая видимые признаки дистресса, связанные с эпизодами заикания.
Заключение
Места поражения, вызывающие нейрогенное заикание, отображаются в общей мозговой сети, которая включает области мозга, которые также демонстрируют значимость для стойкого заикания развития, что предполагает общий нейронный субстрат для всех этиологий. Результаты перекрываются в левой постеровентральной скорлупе, включая вентральный клауструм и амигдалостриатную переходную область. В совокупности эти нейроанатомические результаты обеспечивают связи с функциями мозга, поддерживающими характеристики заикания.Из многих теоретических описаний заикания, предложенных ранее, наши данные подтверждают важную роль базальных ганглиев. Важно отметить, что наши результаты предполагают конкретную и биологически правдоподобную нейроанатомическую схему заикания, сосредоточенную на постеровентральной части левой скорлупы, которая отвечает за автоматизацию и внутреннюю синхронизацию для последовательности сложных двигательных движений губ и других артикуляторов. Дополнительные результаты, указывающие на участие вентральной ограды и переходной области миндалины и стриата в заикании, предоставляют важное новое направление в картировании нейронной основы заикания и гарантируют, что могут быть разработаны наилучшие возможные диагностические и лечебные подходы.
Источники
1.Quick Statistics About Voice, Speech, Language | NIDCD. [cited 2023 Aug 22].2.Pringsheim T, Jette N, Frolkis A, Steeves TDL. The prevalence of Parkinson’s disease: A systematic review and meta-analysis. Mov Disord. 2014;29:1583–1590. pmid:24976103
3.Code C, Petheram B. Delivering for aphasia. Int J Speech-Lang Pathol. 2011;13:3–10. pmid:21329405
4.Simonyan K, Barkmeier-Kraemer J, Blitzer A, Hallett M, Houde JF, Kimberley TJ, et al. Laryngeal Dystonia: Multidisciplinary Update on Terminology, Pathophysiology, and Research Priorities. Neurology. 2021;96:989–1001. pmid:33858994
5.Yairi E, Ambrose N. Epidemiology of stuttering: 21st century advances. J Fluency Disord. 2013;38:66–87. pmid:23773662
6.Sommer M, Waltersbacher A, Schlotmann A, Schröder H, Strzelczyk A. Prevalence and Therapy Rates for Stuttering, Cluttering, and Developmental Disorders of Speech and Language: Evaluation of German Health Insurance Data. Front Hum Neurosci. 2021;15:645292. pmid:33912020
7.Boyce JO, Jackson VE, Reyk O, Parker R, Vogel AP, Eising E, et al. Self-reported impact of developmental stuttering across the lifespan. Dev Medicine Child Neurology. 2022. pmid:35307825
8.Zablotsky B, Black LI, Maenner MJ, Schieve LA, Danielson ML, Bitsko RH, et al. Prevalence and Trends of Developmental Disabilities among Children in the United States: 2009–2017. Pediatrics. 2019;144:e20190811. pmid:31558576
9.McLeod S, Crowe K. Children’s Consonant Acquisition in 27 Languages: A Cross-Linguistic Review. Am J Speech-lang Pat. 2018;27:1546–1571. pmid:30177993
10.Rowe ML. A Longitudinal Investigation of the Role of Quantity and Quality of Child-Directed Speech in Vocabulary Development: Child-Directed Speech and Vocabulary. Child Dev. 2012;83:1762–1774. pmid:22716950
11.Huttenlocher J, Vasilyeva M, Cymerman E, Levine S. Language input and child syntax. Cognitive Psychol. 2002;45:337–374. pmid:12480478
12.Ballard KJ, Djaja D, Arciuli J, James DGH, van Doorn J. Developmental Trajectory for Production of Prosody: Lexical Stress Contrastivity in Children Ages 3 to 7 Years and in Adults. J Speech Lang Hear Res. 2012;55:1822–1835.
13.Constantino CD, Leslie P, Quesal RW, Yaruss JS. A preliminary investigation of daily variability of stuttering in adults. J Commun Disord. 2016;60:39–50. pmid:26945438
14.Shulman E. Factors influencing the variabilty of stuttering. In: Johnson W, Leutenegger R, editors. Stuttering in children and adults. University of Minnesota Press; 1995.
15.Tichenor SE, Yaruss JS. Variability of Stuttering: Behavior and Impact. Am J Speech-lang Pat. 2021;30:75–88. pmid:33197323
16.Jackson ES, Tiede M, Beal D, Whalen DH. The Impact of Social–Cognitive Stress on Speech Variability, Determinism, and Stability in Adults Who Do and Do Not Stutter. J Speech Lang Hear Res. 2016;59:1295–1314. pmid:27936276
17.Sønsterud H, Howells K, Ward D. Covert and overt stuttering: Concepts and comparative findings. J Commun Disord. 2022;99:106246. pmid:35858497
18.Bowers A. Will Brain Imaging Lead to a Translational Neuroscience of Stuttering? Perspect ASHA Spéc Interes Groups. 2023;8:943–954. 19.Smith A, Weber C. How Stuttering Develops: The Multifactorial Dynamic Pathways Theory. J Speech Lang Hear Res. 2017;60:2483–2505. pmid:28837728
20.Ludlow CL, Loucks T. Stuttering: a dynamic motor control disorder. J Fluency Disord. 2004;28:273–295. pmid:14643066
21.MacPherson MK, Smith A. Influences of Sentence Length and Syntactic Complexity on the Speech Motor Control of Children Who Stutter. J Speech Lang Hear Res. 2013;56:89–102. pmid:22490621
22.Eichorn N, Pirutinsky S. Dual-Task Effects on Concurrent Speech Production in School-Age Children With and Without Stuttering Disorders. J Speech Lang Hear Res. 2022;65:2144–2159. pmid:35658493
23.Alm PA. Stuttering in relation to anxiety, temperament, and personality: Review and analysis with focus on causality. J Fluen Disord. 2014;40:5–21. pmid:24929463 24.Graham SA, Fisher SE. Understanding Language from a Genomic Perspective. Annu Rev Genet. 2015;49:131–160. pmid:26442845
25.Eising E, Mirza-Schreiber N, de Zeeuw EL, Wang CA, Truong DT, Allegrini AG, et al. Genome-wide analyses of individual differences in quantitatively assessed reading- and language-related skills in up to 34,000 people. Proc Natl Acad Sci U S A. 2022;119:e2202764119. pmid:35998220
26.Domingues CE, Drayna D. The genetics of stuttering. eLS. 2015:1–8.
27.Kang C, Riazuddin S, Mundorff J, Krasnewich D, Friedman P, Mullikin JC, et al. Mutations in the Lysosomal Enzyme–Targeting Pathway and Persistent Stuttering. New Engl J Medicine. 2010;362:677–685. pmid:20147709
28.Raza MH, Mattera R, Morell R, Sainz E, Rahn R, Gutierrez J, et al. Association between Rare Variants in AP4E1, a Component of Intracellular Trafficking, and Persistent Stuttering. Am J Hum Genetics. 2015;97:715–725. pmid:26544806
29.Thompson-Lake DGY, Scerri TS, Block S, Turner SJ, Reilly S, Kefalianos E, et al. Atypical development of Broca’s area in a large family with inherited stuttering. Brain J Neurology. 2022;145:1177–1188. pmid:35296891
30.Morgan AT, Scerri TS, Vogel AP, Reid CA, Quach M, Jackson VE, et al. Stuttering associated with a pathogenic variant in the chaperone protein cyclophilin 40. Brain. 2023:awad314. pmid:37977818
31.Chow HM, Garnett EO, Li H, Etchell A, Sepulcre J, Drayna D, et al. Linking Lysosomal Enzyme Targeting Genes and Energy Metabolism with Altered Gray Matter Volume in Children with Persistent Stuttering. Neurobiol Lang. 2020;1:365–380. pmid:34041495
32.Benito-Aragón C, Gonzalez-Sarmiento R, Liddell T, Diez I, d’Oleire UF, Ortiz-Terán L, et al. Neurofilament-lysosomal genetic intersections in the cortical network of stuttering. Prog Neurobiol. 2020;184:101718. pmid:31669185
33.Chow HM, Li H, Liu S, Frigerio-Domingues C, Drayna D. Neuroanatomical anomalies associated with rare AP4E1 mutations in people who stutter. Brain Commun. 2021;3:fcab266. pmid:34859215
34.Polikowsky HG, Shaw DM, Petty LE, Chen H-H, Pruett DG, Linklater JP, et al. Population-based genetic effects for developmental stuttering. Hum Genetics Genom Adv. 2022;3:100073. pmid:35047858
35.Deriziotis P, Fisher SE. Speech and Language: Translating the Genome. Trends Genet. 2017;33:642–656. pmid:28781152
36.Eising E, Carrion-Castillo A, Vino A, Strand EA, Jakielski KJ, Scerri TS, et al. A set of regulatory genes co-expressed in embryonic human brain is implicated in disrupted speech development. Mol Psychiatr. 2019;24:1065–1078. pmid:29463886
37.Fox PT, Ingham RJ, Ingham JC, Hirsch TB, Downs JH, Martin C, et al. A PET study of the neural systems of stuttering. Nature. 1996;382:158–162. pmid:8700204 38.Watkins KE, Smith SM, Davis S, Howell P. Structural and functional abnormalities of the motor system in developmental stuttering. Brain. 2008;131:50–59. pmid:17928317
39.Preibisch C, Neumann K, Raab P, Euler HA, Wolff von Gudenberg A, Lanfermann H, et al. Evidence for compensation for stuttering by the right frontal operculum. Neuroimage. 2003;20:1356–1364. pmid:14568504
40.Kell CA, Neumann K, Behrens M, Wolff von Gudenberg A, Giraud A-L. Speaking-related changes in cortical functional connectivity associated with assisted and spontaneous recovery from developmental stuttering. J Fluency Disord. 2018;55:135–144. pmid:28216127
41.Giraud A-L, Neumann K, Bachoud-Levi A-C, Wolff von Gudenberg A, Euler HA, Lanfermann H, et al. Severity of dysfluency correlates with basal ganglia activity in persistent developmental stuttering. Brain Lang. 2008;104:190–199. pmid:17531310
42.Sitek KR, Cai S, Beal DS, Perkell JS, Guenther FH, Ghosh SS. Decreased Cerebellar-Orbitofrontal Connectivity Correlates with Stuttering Severity: Whole-Brain Functional and Structural Connectivity Associations with Persistent Developmental Stuttering. Front Hum Neurosci. 2016;10:190. pmid:27199712 43.Frankford SA, Murray ESH, Masapollo M, Cai S, Tourville JA, Nieto-Castañón A, et al. The Neural Circuitry Underlying the “Rhythm Effect” in Stuttering. J Speech Lang Hear Res. 2021;64:2325–2346. pmid:33887150
44.Wu JC, Maguire G, Riley G, Lee A, Keator D, Tang C, et al. Increased dopamine activity associated with stuttering. Neuroreport. 1997;8:767–770. pmid:9106763
45.De Nil LF, Kroll RM, Houle S. Functional neuroimaging of cerebellar activation during single word reading and verb generation in stuttering and nonstuttering adults. Neurosci Lett. 2001;302:77–80. pmid:11290391
46.Neef NE, Bütfering C, Auer T, Metzger FL, Euler HA, Frahm J, et al. Altered morphology of the nucleus accumbens in persistent developmental stuttering. J Fluency Disord. 2018;55:84–93. pmid:28595893
47.Toyomura A, Fujii T, Yokosawa K, Kuriki S. Speech Disfluency-dependent Amygdala Activity in Adults Who Stutter: Neuroimaging of Interpersonal Communication in MRI Scanner Environment. Neuroscience. 2018;374:144–154. pmid:29378280
48.Neumann K, Euler HA, Kob M, Wolff von Gudenberg A, Giraud A-L, Weissgerber T, et al. Assisted and unassisted recession of functional anomalies associated with dysprosody in adults who stutter. J Fluency Disord. 2018;55:120–134. pmid:28958627
49.Connally EL, Ward D, Howell P, Watkins KE. Disrupted white matter in language and motor tracts in developmental stuttering. Brain Lang. 2014;131:25–35. pmid:23819900
50.Johnson CA, Liu Y, Waller N, Chang S-E. Tract profiles of the cerebellar peduncles in children who stutter. Brain Struct Funct. 2022;227:1773–1787. pmid:35220486 51.Neef NE, Anwander A, Bütfering C, Schmidt-Samoa C, Friederici AD, Paulus W, et al. Structural connectivity of right frontal hyperactive areas scales with stuttering severity. Brain. 2018;141:191–204. pmid:29228195
52.Kronfeld-Duenias V, Amir O, Ezrati-Vinacour R, Civier O, Ben-Shachar M. The frontal aslant tract underlies speech fluency in persistent developmental stuttering. Brain Struct Funct. 2016;221:365–381. pmid:25344925
53.Neef NE, Anwander A, Friederici AD. The Neurobiological Grounding of Persistent Stuttering: from Structure to Function. Curr Neurol Neurosci Rep. 2015;15:63. pmid:26228377
54.Connally EL, Ward D, Pliatsikas C, Finnegan S, Jenkinson M, Boyles R, et al. Separation of trait and state in stuttering. Hum Brain Mapp. 2018;39:3109–3126. pmid:29624772
55.Watkins KE, Chesters J, Connally EL. The neurobiology of developmental stuttering. In: Hickok G, Small S, editors. Neurobiology of Language. 2016. p. 995–1004. View ArticleGoogle Scholar
56.Budde KS, Barron DS, Fox PT. Stuttering, induced fluency, and natural fluency: A hierarchical series of activation likelihood estimation meta-analyses. Brain Lang. 2014;139:99–107. pmid:25463820
57.Chang S-E, Guenther FH. Involvement of the Cortico-Basal Ganglia-Thalamocortical Loop in Developmental Stuttering. Front Psychol. 2020;10:3088. pmid:32047456
58.Craig-McQuaide A, Akram H, Zrinzo L, Tripoliti E. A review of brain circuitries involved in stuttering. Front Hum Neurosci. 2014;8:884. pmid:25452719
59.Chang S-E, Garnett EO, Etchell A, Chow HM. Functional and Neuroanatomical Bases of Developmental Stuttering: Current Insights. Neurosci. 2019;25:566–582. pmid:30264661
60.Brainard MS, Doupe AJ. Translating Birdsong: Songbirds as a Model for Basic and Applied Medical Research. Annu Rev Neurosci. 2013;36:489–517. pmid:23750515
61.Nieder A, Mooney R. The neurobiology of innate, volitional and learned vocalizations in mammals and birds. Philos Trans R Soc B. 2020;375:20190054. pmid:31735150
62.Ziegler W, Ackermann H. Subcortical Contributions to Motor Speech: Phylogenetic, Developmental, Clinical. Trends Neurosci. 2017;40:458–468. pmid:28712469
63.Petkov CI, Jarvis ED. Birds, primates, and spoken language origins: behavioral phenotypes and neurobiological substrates. Front Evol Neurosci. 2012;4:12. pmid:22912615
64.Zhang YS, Ghazanfar AA. A Hierarchy of Autonomous Systems for Vocal Production. Trends Neurosci. 2020;43:115–126. pmid:31955902
65.Meier AM, Guenther FH. Neurocomputational modeling of speech motor development. J Child Lang. 2023;1–18. pmid:37337871
66.Hull C. The cerebellum influences vocal timing. eLife. 2018;7:e40447. pmid:30152753
67.Simmonds AJ, Leech R, Iverson P, Wise RJS. The response of the anterior striatum during adult human vocal learning. J Neurophysiol. 2014;112:792–801. pmid:24805076
68.Jürgens U. The Neural Control of Vocalization in Mammals: A Review. J Voice. 2009;23:1–10. pmid:18207362
69.Hage SR, Gavrilov N, Nieder A. Cognitive Control of Distinct Vocalizations in Rhesus Monkeys. J Cognitive Neurosci. 2013;25:1692–1701. pmid:23691983
70.Loh KK, Procyk E, Neveu R, Lamberton F, Hopkins WD, Petrides M, et al. Cognitive control of orofacial motor and vocal responses in the ventrolateral and dorsomedial human frontal cortex. Proc National Acad Sci U S A. 2020;117:4994–5005. pmid:32060124
71.Jürgens U. The role of the periaqueductal grey in vocal behaviour. Behav Brain Res. 1994;62:107–117. pmid:7945960
72.Jürgens U, von Cramon D. On the role of the anterior cingulate cortex in phonation: A case report. Brain Lang. 1982;15:234–248. pmid:7074343
73.Tschida K, Michael V, Takatoh J, Han B-X, Zhao S, Sakurai K, et al. A Specialized Neural Circuit Gates Social Vocalizations in the Mouse. Neuron. 2019;103:459–472.e4. pmid:31204083
74.Gloveli N, Simonnet J, Tang W, Concha-Miranda M, Maier E, Dvorzhak A, et al. Play and tickling responses map to the lateral columns of the rat periaqueductal gray. Neuron. 2023. pmid:37516112
75.Gerbella M, Pinardi C, Cesare GD, Rizzolatti G, Caruana F. Two Neural Networks for Laughter: A Tractography Study. Cereb Cortex. 2020;31:899–916. pmid:32969467 76.Garnett EO, Chow HM, Nieto-Castañón A, Tourville JA, Guenther FH, Chang S-E. Anomalous morphology in left hemisphere motor and premotor cortex of children who stutter. Brain. 2018;141:2670–2684. pmid:30084910
77.Chow HM, Garnett EO, Koenraads SPC, Chang S-E. Brain developmental trajectories associated with childhood stuttering persistence and recovery. Dev Cogn Neurosci. 2023;60:101224. pmid:36863188
78.Chang S-E, Zhu DC, Choo AL, Angstadt M. White matter neuroanatomical differences in young children who stutter. Brain. 2015;138:694–711. pmid:25619509
79.Chow HM, Chang S. White matter developmental trajectories associated with persistence and recovery of childhood stuttering. Hum Brain Mapp. 2017;38:3345–3359. pmid:28390149
80.Neef NE, Angstadt M, Koenraads SPC, Chang S-E. Dissecting structural connectivity of the left and right inferior frontal cortex in children who stutter. Cereb Cortex. 2022. pmid:36057839
81.Chow HM, Garnett EO, Ratner NB, Chang S-E. Brain activity during the preparation and production of spontaneous speech in children with persistent stuttering. NeuroImage Clin. 2023;38:103413. pmid:37099876
82.Chang S-E, Angstadt M, Chow HM, Etchell AC, Garnett EO, Choo AL, et al. Anomalous network architecture of the resting brain in children who stutter. J Fluency Disord. 2018;55:46–67. pmid:28214015
83.Belyk M, Kraft SJ, Brown S. Stuttering as a trait or state–an ALE meta-analysis of neuroimaging studies. Eur J Neurosci. 2015;41:275–284. pmid:25350867 84.Braun AR, Varga M, Stager S, Schulz G, Selbie S, Maisog JM, et al. Altered patterns of cerebral activity during speech and language production in developmental stuttering. An H2(15)O positron emission tomography study. Brain. 1997;120:761–784. pmid:9183248
85.Neef NE, Bütfering C, Anwander A, Friederici AD, Paulus W, Sommer M. Left posterior-dorsal area 44 couples with parietal areas to promote speech fluency, while right area 44 activity promotes the stopping of motor responses. Neuroimage. 2016;142:628–644. pmid:27542724
86.Chang S-E, Kenney MK, Loucks TMJ, Ludlow CL. Brain activation abnormalities during speech and non-speech in stuttering speakers. Neuroimage. 2009;46:201–212. pmid:19401143
87.Cai S, Tourville JA, Beal DS, Perkell JS, Guenther FH, Ghosh SS. Diffusion imaging of cerebral white matter in persons who stutter: evidence for network-level anomalies. Front Hum Neurosci. 2014;8:54. pmid:24611042
88.Qiao J, Wang Z, Zhao G, Huo Y, Herder CL, Sikora CO, et al. Functional neural circuits that underlie developmental stuttering. PLoS ONE. 2017;12:e0179255. pmid:28759567
89.Chang S-E, Zhu DC. Neural network connectivity differences in children who stutter. Brain. 2013;136:3709–3726. pmid:24131593