Введение
Среди расстройств коммуникации заикание является одним из наиболее часто встречающихся, намного превосходя дистонию гортани, афазию и проблемы с речью, вызванные болезнью Паркинсона, вместе взятые [ 1 – 6 ]. Это речевое расстройство, при котором говорящие точно знают, что они хотят сказать, и могут координировать и двигать своими голосовыми органами, но происходит периодическая потеря контроля, когда движения артикулятора замирают или попадают в холостой цикл во время заикания. Явными первичными симптомами являются речевые блоки, повторения звуков и слогов, а также удлинения звуков, которые нарушают обычный плавный, автоматический процесс производства речи. Сопутствующее физическое поведение, такое как моргание глазами, гримасничанье или посторонние движения конечностей и тела, может сопровождать заикание. Скрытые последствия варьируются от стыда и разочарования до социальной тревожности. Заикание может серьезно ограничить сферу межличностного вербального общения и создать барьеры, которые влияют на результаты образования и трудоустройства [7].
Начало заикания происходит либо внезапно, либо постепенно в раннем детстве в возрасте от 2 до 5 лет [ 5 , 6 , 8 ]. До 8% детей дошкольного возраста начинают заикаться, и около пятой части сохраняют заикание на всю жизнь [ 5 ]. Примерно в тот же период развития, когда начинается заикание, дети укрепляют свою артикуляционную систему [ 9 ], расширяют свой активный словарный запас [ 10 ], учатся объединять слова в более длинные и сложные фразы [ 11 ] и прогрессируют в приобретении типичного ритма и просодических моделей своего языка [ 12 ]. Помимо развития речи и языка, в этом возрасте дети также приобретают когнитивные, социальные и эмоциональные навыки, чтобы ориентироваться в повседневных коммуникативных контекстах. Таким образом, во многих случаях заикание возникает, когда мозг обладает замечательной способностью к пластичности. Структура и развитие функций мозга детей находятся под сложным влиянием их опыта, реакций и взаимодействий. Эта сложность создает значительную проблему при определении вклада как генетической предрасположенности (природы), так и влияния окружающей среды (воспитания) в возникновение и ремиссию заикания.
Выяснение нейробиологической основы заикания еще больше затрудняется из-за колебаний, изменчивости и гетерогенности симптомов. В частности, заикание характеризуется перемежаемостью у заикающихся людей и изменчивостью среди заикающейся популяции. Внутриличностная перемежаемость отражается в изменчивости тяжести симптомов в течение дней, недель и месяцев [ 13 , 14 ]. Более того, видимые и слышимые признаки и, таким образом, явная тяжесть симптомов варьируются в зависимости от личности, социального контекста, коммуникативных целей и аффективного состояния [ 15 , 16 ]. В дополнение к явному речевому поведению заикающиеся люди могут разрабатывать богатый спектр стратегий, чтобы скрыть свое заикание, например, избегая звуков или слов, перефразируя высказывания или вставляя междометия и начальные или заполняющие слова. Как и в случае явного заикания, степень скрытности варьируется у разных людей и в разных ситуациях. То, как воспринимается и переживается тяжесть собственного заикания, явного или скрытого, также варьируется от человека к человеку [ 17 ]. Поэтому следует отметить, что прерывистость заикания, большая неоднородность поведения при заикании и индивидуальный внутренний опыт заикания создают проблемы для его операционализации. Однако большинство исследований нейровизуализации, проведенных до сих пор, в первую очередь были сосредоточены на явном заикании как ключевой поведенческой особенности для изучения мозговых коррелятов [ 18 ]. На этом фоне становится ясно, что наши текущие знания о нейробиологических основах заикания должны быть неполными.
Учитывая относительно высокую заболеваемость и значительные психосоциальные последствия, мы все еще относительно мало знаем об этиологии заикания. С точки зрения нейробиологии, это идиопатическое состояние с множеством убедительных характеристик — нарушение речевого моторного контроля в его основе [ 19 , 20 ], с тяжестью симптомов, на которую влияют, но не вызывают, язык высшего порядка [ 21 ], когнитивные [ 22 ] или эмоциональные процессы [ 23 ]. Фундаментальные вопросы, связанные с природой заикания, остаются без ответа. В этой Неразгаданной тайне мы освещаем многие такие вопросы, организованные по основным темам, и достижения исследований, относящиеся к нейробиологии заикания, которые способствовали нашему пониманию этого сложного речевого состояния.
Является ли заикание генетическим заболеванием?
Генетические исследования людей, которые заикаются, имеют потенциал не только открыть окна в ключевые молекулярно-биологические условия расстройства, но и расширить наши знания о нейробиологических механизмах, позволяющих людям приобретать и воспроизводить нормальную речь. Как и в большинстве случаев нарушений развития речи и языка, заикание является богатым фенотипом и, вероятно, включает в себя сложную генетическую архитектуру, которая является результатом наследования множественных факторов риска с небольшим индивидуальным влиянием [ 24 , 25 ].

Первые подсказки о генетическом вкладе были получены из исследований наследуемости на основе близнецов, которые показали, что вероятность заикания у обоих близнецов существенно выше у монозиготных, чем у дизиготных близнецов [ 26 ]. Наследуемость была дополнительно продемонстрирована высоким положительным уровнем семейного анамнеза. Примерно 50% людей, которые заикаются, сообщают по крайней мере об одном дополнительном родственнике, который заикается, по оценкам клинически подтвержденных когорт [ 7 ]. Однако, поскольку наследуемость существенно меньше 100%, факторы риска окружающей среды также должны вносить свой вклад.
Половая предвзятость дает еще один намек на генетический вклад. Заикание сохраняется у 1% взрослого населения, преимущественно у мужчин с соотношением мужчин и женщин 1:4. Напротив, при начале заикания в раннем детстве соотношение мужчин и женщин составляет 1:2 [ 5 ]. Поскольку эпидемиологические данные указывают на то, что женщины, страдающие заиканием, чаще восстанавливаются после заикания, чем мужчины, можно предположить, что нейробиологические факторы, связанные с полом, влияют на способность мозга восстанавливаться после заикания; однако основные механизмы нейроразвития неизвестны.
Достижения в области генетического секвенирования позволили провести исследования сцепления в больших кровнородственных семьях с несколькими затронутыми членами. В таких семьях заикание неоднократно связывали с редкими вариантами генов лизосомального таргетингового пути ( GNPTAB , GNPTG , NAGPA , AP4E1 ) [ 27 , 28 ] и другими новыми хромосомными локусами [ 29 , 30 ]. Эти многообещающие открытия дали повод для более поздних исследований нейровизуализации с целью изучения связи между генами риска и структурами мозга [ 29 , 31–33 ]. Однако, хотя выявление вариантов функциональной значимости в моделях косегрегации больших семей помогает обнаружить причинно - следственную связь, только вариации тех же локусов риска у нескольких неродственных людей, которые заикаются, могли бы установить действительно функциональные связи. Первое исследование ассоциаций генома развития заикания не смогло воспроизвести ранее идентифицированные локусы, что поставило под сомнение значимость ранее идентифицированных генов для общей популяции с заиканием [ 34 ]. Ограниченный успех можно объяснить в основном малым размером выборки, который недостаточен для обнаружения однонуклеотидных полиморфизмов с ожидаемыми небольшими эффектами на фоне высокой случайной изменчивости индивидуальных геномов [ 35 ]. Для надежных ассоциаций могут потребоваться десятки тысяч генотипированных и фенотипированных участников [ 25 ]. Чтобы преодолеть этот значительный недостаток статистической мощности, было бы полезно расширить клинические процедуры путем сбора образцов ДНК для секвенирования и включения стандартизированных облачных тестовых батарей для документирования дисперсии в фенотипах заикания.
В настоящее время новые высокопроизводительные и массивно-параллельные технологии секвенирования ДНК требуют существенно меньших затрат и времени, чем предыдущие технологии, для секвенирования всего человеческого генома. Такое секвенирование всего генома уже начало связывать молекулярные пути, которые регулируют экспрессию генов во время раннего развития мозга, с нарушениями речи и языка [ 36 ]. Биологические и клинические данные на уровне популяции могут помочь в выявлении клинико-молекулярно-биохимических подтипов заикания в будущем.
Каковы нейронные маркеры стойкого заикания?
При использовании современных технологий визуализации для исследования мозга человека, страдающего заиканием, маловероятно, что мы обнаружим явные морфологические или функциональные аномалии. Как структуры серого, так и белого вещества будут выглядеть хорошо сформированными и на своих местах у людей, страдающих заиканием, и первоначальные наблюдения мозговых волн не будут казаться нетипичными. Заикание не проявляет явных признаков, таких как видимый перелом на рентгеновском снимке или явная дезорганизованная электрическая активность, наблюдаемая на электрокардиограмме при сердечной аритмии. Однако перспектива меняется при сравнении данных, полученных от разных групп людей. Через призму статистического анализа становится возможным выявить тонкие нейронные отклонения. Более 2 десятилетий исследований мозга накопили доказательства структурных и функциональных нейронных коррелятов заикания.
И дети, и взрослые, которые заикаются, демонстрируют нетипичную структуру мозга и функциональные паттерны, которые можно локализовать и которые являются частью ряда основных нейронных сетей. Вовлечены корковые области сетей планирования и контроля речевых моторных функций ( смотрите картинку ), включая области лобных долей, такие как моторная кора, премоторная кора, нижняя лобная извилина, лобная покрышка, островковая кора и пресупплементарные и дополнительные двигательные области [ 37–39 ] . Также вовлечены теменные и височные перисильвиевые области, такие как супрамаргинальная извилина, и слуховые области более высокого порядка, которые могут быть связаны с различиями в сенсомоторной интеграции и управлении обратной связью [ 37 , 38 , 40 ]. Кроме того, задействованы подкорковые структуры, такие как базальные ганглии, таламус и мозжечок, что может быть связано с различиями в функциях обучения, инициирования, синхронизации, последовательности и контроля ошибок [ 37 , 38 , 41–45 ] . Морфологические различия в лимбических областях мозга, участвующих в обработке вознаграждения и регуляции эмоций, таких как прилежащее ядро и миндалевидное тело, связаны с постоянным заиканием [ 46–48 ] . Наряду с дисфункциональными областями серого вещества, также сообщалось об изменениях в структурах белого вещества, включая дугообразный пучок, верхний продольный пучок, лобный косой тракт, кортико- бульбарные тракты и мозжечковые отростки, которые отвечают за передачу информации между областями мозга, участвующими в производстве речи и контроле движений [ 49–52 ]. Были проведены комплексные обзоры как маркеров состояния, так и черт характера заикания, которые доступны в существующей литературе [ 53 – 59 ].
Речедвигательная система
Сравнительные исследования между вокальными позвоночными, включая костистых рыб, певчих птиц и млекопитающих, показывают, что иерархически организованные двигательные пути способствуют вокальному поведению [ 60 – 64 ]. Вместе с клиническими исследованиями случаев, нейровизуализацией и прямой электрической стимуляцией у людей соответствующие результаты в основном формируют наше текущее понимание нейроанатомии речи. Транскаллозальные и кортико-кортикальные связи между речевыми моторными, слуховыми и соматосенсорными областями, кортико-таламо-кортикальные петли через базальные ганглии и мозжечково-таламо-базальные ганглии, как полагают, играют решающую роль в поддержке обучения речи и автоматизации [ 60 , 65 – 68 ], особенно в критический период сенсомоторного обучения. Автоматизация фрагментированной выходной последовательности речевых моторов может задействовать синапсы между премоторной и моторной корой [ 60 , 65 ]. В конечном итоге, в зрелой системе вокальной речи набор левых вентролатеральных и дорсомедиальных фронтальных областей мозга играет ключевую роль в произвольном инициировании речи [ 61 , 69 , 70 ], распространяя свои выходные сигналы к орофациальным и респираторным двигательным нейронам в стволе мозга, чтобы приводить в действие наши речевые органы ( рис. 1 ).
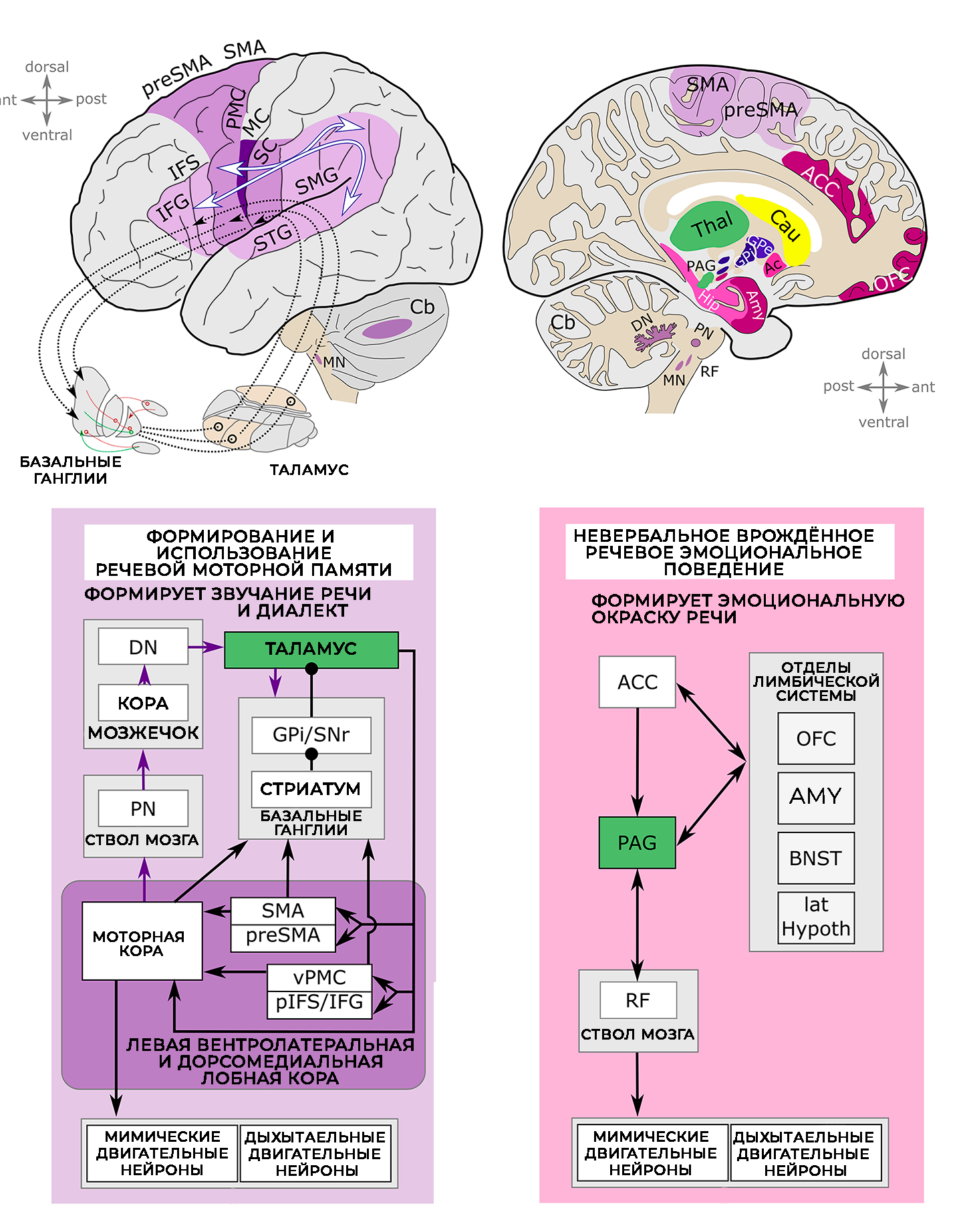

Помимо волевой артикуляционной двигательной сети ( рис. 1 ), отмеченной на изображении фиолетовым цветом, первичная вокальная двигательная сеть ( рис. 1 ), отмеченная на изображении насыщенным пурпурным цветом, проходит от передней поясной коры через околоводопроводное серое вещество в ретикулярную формацию моста и продолговатого мозга, а оттуда к орофациальным и гортанным мотонейронам [ 61 , 68 , 71 ]. Передняя поясная кора и околоводопроводное серое вещество получают входные данные от лимбических структур мозга, включая миндалевидное тело, ядро ложа конечной полосатой оболочки и латеральный гипоталамус [ 71 , 72 ]. Околоводопроводное серое вещество, по-видимому, контролирует готовность к вокализации у нечеловекообразных приматов и управляет социальной и игровой вокализацией у грызунов [ 73 , 74 ]. Передняя поясная кора хорошо расположена для интеграции познания, эмоций и действий. Ее электрическая стимуляция у людей вызывает мимику, интероцептивные ощущения, автономные реакции, смех и улыбку, что указывает на то, что она может организовывать социальное эмоциональное поведение [ 75 ].
Человеческая речь основана на значительно более широком наборе областей мозга, а сложная сеть связей внутри человеческого коннектома заметно более обширна. Изображенные области мозга и контуры ( рис. 1 ) представляют собой основных участников в механизме производства вокальной речи, и хотя все изображенные компоненты произвольной артикуляционной моторной сети связаны с заиканием, компоненты первичной вокальной моторной сети также, по-видимому, задействованы, включая переднюю поясную кору, миндалевидное тело и орбитофронтальную кору.
Кроме того, у детей с постоянным заиканием методы МРТ показали морфологические различия в корковых и подкорковых двигательных структурах, включая уменьшение толщины коры в левых премоторных и двигательных областях [ 76 ], а также уменьшение объема серого вещества в левой вентральной премоторной коре и подкорковых областях, включая базальные ганглии [ 77 ]. Также наблюдались различия в структуре белого вещества, затрагивающие области, участвующие в слухо-моторной интеграции, инициации движения, мониторинге и межполушарной координации [ 77–80 ] . Эти структурные различия коррелируют с тяжестью заикания [ 77 ], что предполагает их связь с беглостью речи.
Во время спонтанного речевого производства дети с устойчивым заиканием демонстрируют сниженную мозговую активность в левой премоторной коре и базальных ганглиях по сравнению с детьми, которые не заикаются [ 81 ]. Кроме того, исследования указывают на первоначальные доказательства крупномасштабных различий в связях нейронных сетей у детей с устойчивым заиканием, особенно в отношении взаимодействия между речевыми двигательными сетями и другими сетями когнитивного контроля [ 82 ].
Каковы наиболее поразительные различия между аномалиями мозга у взрослых и детей, которые заикаются? В отличие от детей, взрослые часто демонстрируют повышенную речевую активность и связность в корковых структурах правого полушария, охватывающих лобные и теменные области, роландическую покрышку и островок [ 37 , 38 , 83 ]. Эта выраженная активация в правом полушарии превышает активацию соответствующих речевых областей в левом полушарии [ 56 , 84 , 85 ], что приводит к давним дискуссиям относительно ее потенциальной роли в качестве компенсаторного механизма [ 39 , 84 ]. Отсутствие подобного правостороннего сдвига у детей [ 81 ] подтверждает эту предложенную компенсаторную гипотезу. Однако данные МРТ, связанные с выполнением задач у детей, скудны, а недавние исследования представляют более разнообразную точку зрения, предполагая, что изменения, наблюдаемые в правом полушарии, могут представлять собой комбинацию как компенсаторных усилий, так и прямых проявлений заикания [ 51 , 80 , 85 ].
В отличие от взрослых, недавний отчет показал, что дети, которые впоследствии будут иметь постоянное заикание, демонстрируют значительно уменьшенный объем скорлупы на ранних этапах развития [ 77 ]. Однако это несоответствие уменьшается с возрастом, и во взрослом возрасте возникает интригующий парадокс, когда взрослые, которые заикаются, демонстрируют повышенную нейронную активность в базальных ганглиях, включая скорлупу [ 86 ] и хвостатое ядро [ 41 ]. Одна из правдоподобных гипотез заключается в том, что рано возникающая структурная дисперсия в базальных ганглиях может изначально способствовать наблюдаемым групповым различиям, но это различие нормализуется со временем из-за каскадов развития, влияющих на взаимосвязанные структуры мозга. Например, структурная дисперсия в базальных ганглиях на ранних этапах развития и ее связь с дополнительной двигательной областью могут потенциально оказывать влияние на различные траектории развития в таких областях, как таламус и мозжечок. Необходимы дальнейшие исследования для выяснения точных механизмов, лежащих в основе этой динамики развития у людей, страдающих заиканием.
В целом, результаты визуализации показывают, что заикание, как и другие сложные расстройства, можно отнести к нарушениям на уровне сети [ 82 , 87–89 ]. Вовлеченные сети включают основные центры приобретения и автоматизации речевых двигательных навыков, сенсомоторную интеграцию, обратную связь и мониторинг ошибок, познание и целенаправленное поведение, а также лимбические структуры, координирующие аффект и социальный контекст. Эти сети интегрируют общие процессы , вовлеченные в вербальную коммуникацию, включая множественные временные масштабы от миллисекунд для голосовых функций до секунд для просодических функций. Таким образом, беглая речь требует нейронной организации иерархических представлений двигательной последовательности, которые достаточно стабильны, чтобы автоматически выполняться, и в то же время достаточно гибки, чтобы адаптироваться к аффективным, социальным и целенаправленным требованиям.
Вопросы
Несмотря на рассмотренные в этом разделе достижения в области исследований, ответы на следующие вопросы остаются неясными.
1) Как критический период освоения речи формирует взаимодействия между контурами обучения речевой моторике и контурами производства речевой моторики у типично развивающихся и заикающихся детей?
2) Как и когда развивающаяся система переключается между состояниями обучения, состояниями автоматизации и состояниями, требующими мониторинга через центральные исполнительные или сенсорные системы управления обратной связью?
3) Какие базовые нейронные цепи отвечают за переход между чистым привычным выполнением речевых движений и состояниями, требующими реализации просодических модуляций на основе социального контекста (например, разговор с домашним животным, другом или авторитетной фигурой) и аффективного состояния (например, чувство удовольствия или гнева)?
4) Как мозг кодирует иерархические представления речевой моторной последовательности?
5) Как на инициацию речевой моторной последовательности влияют иерархические структуры или различные когнитивные и аффективные состояния?
Источники и ссылки
1.Quick Statistics About Voice, Speech, Language | NIDCD. [cited 2023 Aug 22]. Available from: https://www.nidcd. nih.gov/health/statistics/quick-statistics-voice-speech-language
. 2.Pringsheim T, Jette N, Frolkis A, Steeves TDL. The prevalence of Parkinson’s disease: A systematic review and meta-analysis. Mov Disord. 2014;29:1583–1590. pmid:24976103
3.Code C, Petheram B. Delivering for aphasia. Int J Speech-Lang Pathol. 2011;13:3–10. pmid:21329405
4.Simonyan K, Barkmeier-Kraemer J, Blitzer A, Hallett M, Houde JF, Kimberley TJ, et al. Laryngeal Dystonia: Multidisciplinary Update on Terminology, Pathophysiology, and Research Priorities. Neurology. 2021;96:989–1001. pmid:33858994
5.Yairi E, Ambrose N. Epidemiology of stuttering: 21st century advances. J Fluency Disord. 2013;38:66–87. pmid:23773662
6.Sommer M, Waltersbacher A, Schlotmann A, Schröder H, Strzelczyk A. Prevalence and Therapy Rates for Stuttering, Cluttering, and Developmental Disorders of Speech and Language: Evaluation of German Health Insurance Data. Front Hum Neurosci. 2021;15:645292. pmid:33912020
7.Boyce JO, Jackson VE, Reyk O, Parker R, Vogel AP, Eising E, et al. Self-reported impact of developmental stuttering across the lifespan. Dev Medicine Child Neurology. 2022. pmid:35307825
8.Zablotsky B, Black LI, Maenner MJ, Schieve LA, Danielson ML, Bitsko RH, et al. Prevalence and Trends of Developmental Disabilities among Children in the United States: 2009–2017. Pediatrics. 2019;144:e20190811. pmid:31558576
9.McLeod S, Crowe K. Children’s Consonant Acquisition in 27 Languages: A Cross-Linguistic Review. Am J Speech-lang Pat. 2018;27:1546–1571. pmid:30177993
10.Rowe ML. A Longitudinal Investigation of the Role of Quantity and Quality of Child-Directed Speech in Vocabulary Development: Child-Directed Speech and Vocabulary. Child Dev. 2012;83:1762–1774. pmid:22716950
11.Huttenlocher J, Vasilyeva M, Cymerman E, Levine S. Language input and child syntax. Cognitive Psychol. 2002;45:337–374. pmid:12480478
12.Ballard KJ, Djaja D, Arciuli J, James DGH, van Doorn J. Developmental Trajectory for Production of Prosody: Lexical Stress Contrastivity in Children Ages 3 to 7 Years and in Adults. J Speech Lang Hear Res. 2012;55:1822–1835. View ArticleGoogle Scholar
13.Constantino CD, Leslie P, Quesal RW, Yaruss JS. A preliminary investigation of daily variability of stuttering in adults. J Commun Disord. 2016;60:39–50. pmid:26945438
14.Shulman E. Factors influencing the variabilty of stuttering. In: Johnson W, Leutenegger R, editors. Stuttering in children and adults. University of Minnesota Press; 1995.
15.Tichenor SE, Yaruss JS. Variability of Stuttering: Behavior and Impact. Am J Speech-lang Pat. 2021;30:75–88. pmid:33197323
16.Jackson ES, Tiede M, Beal D, Whalen DH. The Impact of Social–Cognitive Stress on Speech Variability, Determinism, and Stability in Adults Who Do and Do Not Stutter. J Speech Lang Hear Res. 2016;59:1295–1314. pmid:27936276
17.Sønsterud H, Howells K, Ward D. Covert and overt stuttering: Concepts and comparative findings. J Commun Disord. 2022;99:106246. pmid:35858497
18.Bowers A. Will Brain Imaging Lead to a Translational Neuroscience of Stuttering? Perspect ASHA Spéc Interes Groups. 2023;8:943–954. View ArticleGoogle Scholar
19.Smith A, Weber C. How Stuttering Develops: The Multifactorial Dynamic Pathways Theory. J Speech Lang Hear Res. 2017;60:2483–2505. pmid:28837728 20.Ludlow CL, Loucks T. Stuttering: a dynamic motor control disorder. J Fluency Disord. 2004;28:273–295. pmid:14643066
21.MacPherson MK, Smith A. Influences of Sentence Length and Syntactic Complexity on the Speech Motor Control of Children Who Stutter. J Speech Lang Hear Res. 2013;56:89–102. pmid:22490621
22.Eichorn N, Pirutinsky S. Dual-Task Effects on Concurrent Speech Production in School-Age Children With and Without Stuttering Disorders. J Speech Lang Hear Res. 2022;65:2144–2159. pmid:35658493
23.Alm PA. Stuttering in relation to anxiety, temperament, and personality: Review and analysis with focus on causality. J Fluen Disord. 2014;40:5–21. pmid:24929463
24.Graham SA, Fisher SE. Understanding Language from a Genomic Perspective. Annu Rev Genet. 2015;49:131–160. pmid:26442845
25.Eising E, Mirza-Schreiber N, de Zeeuw EL, Wang CA, Truong DT, Allegrini AG, et al. Genome-wide analyses of individual differences in quantitatively assessed reading- and language-related skills in up to 34,000 people. Proc Natl Acad Sci U S A. 2022;119:e2202764119. pmid:35998220
26.Domingues CE, Drayna D. The genetics of stuttering. eLS. 2015:1–8. View ArticleGoogle Scholar
27.Kang C, Riazuddin S, Mundorff J, Krasnewich D, Friedman P, Mullikin JC, et al. Mutations in the Lysosomal Enzyme–Targeting Pathway and Persistent Stuttering. New Engl J Medicine. 2010;362:677–685. pmid:20147709
28.Raza MH, Mattera R, Morell R, Sainz E, Rahn R, Gutierrez J, et al. Association between Rare Variants in AP4E1, a Component of Intracellular Trafficking, and Persistent Stuttering. Am J Hum Genetics. 2015;97:715–725. pmid:26544806
29.Thompson-Lake DGY, Scerri TS, Block S, Turner SJ, Reilly S, Kefalianos E, et al. Atypical development of Broca’s area in a large family with inherited stuttering. Brain J Neurology. 2022;145:1177–1188. pmid:35296891
30.Morgan AT, Scerri TS, Vogel AP, Reid CA, Quach M, Jackson VE, et al. Stuttering associated with a pathogenic variant in the chaperone protein cyclophilin 40. Brain. 2023:awad314. pmid:37977818
31.Chow HM, Garnett EO, Li H, Etchell A, Sepulcre J, Drayna D, et al. Linking Lysosomal Enzyme Targeting Genes and Energy Metabolism with Altered Gray Matter Volume in Children with Persistent Stuttering. Neurobiol Lang. 2020;1:365–380. pmid:34041495
32.Benito-Aragón C, Gonzalez-Sarmiento R, Liddell T, Diez I, d’Oleire UF, Ortiz-Terán L, et al. Neurofilament-lysosomal genetic intersections in the cortical network of stuttering. Prog Neurobiol. 2020;184:101718. pmid:31669185
33.Chow HM, Li H, Liu S, Frigerio-Domingues C, Drayna D. Neuroanatomical anomalies associated with rare AP4E1 mutations in people who stutter. Brain Commun. 2021;3:fcab266. pmid:34859215
34.Polikowsky HG, Shaw DM, Petty LE, Chen H-H, Pruett DG, Li
nklater JP, et al. Population-based genetic effects for developmental stuttering. Hum Genetics Genom Adv. 2022;3:100073. pmid:35047858 35.Deriziotis P, Fisher SE. Speech and Language: Translating the Genome. Trends Genet. 2017;33:642–656. pmid:28781152
36.Eising E, Carrion-Castillo A, Vino A, Strand EA, Jakielski KJ, Scerri TS, et al. A set of regulatory genes co-expressed in embryonic human brain is implicated in disrupted speech development. Mol Psychiatr. 2019;24:1065–1078. pmid:29463886
37.Fox PT, Ingham RJ, Ingham JC, Hirsch TB, Downs JH, Martin C, et al. A PET study of the neural systems of stuttering. Nature. 1996;382:158–162. pmid:8700204
38.Watkins KE, Smith SM, Davis S, Howell P. Structural and functional abnormalities of the motor system in developmental stuttering. Brain. 2008;131:50–59. pmid:17928317
39.Preibisch C, Neumann K, Raab P, Euler HA, Wolff von Gudenberg A, Lanfermann H, et al. Evidence for compensation for stuttering by the right frontal operculum. Neuroimage. 2003;20:1356–1364. pmid:14568504
40.Kell CA, Neumann K, Behrens M, Wolff von Gudenberg A, Giraud A-L. Speaking-related changes in cortical functional connectivity associated with assisted and spontaneous recovery from developmental stuttering. J Fluency Disord. 2018;55:135–144. pmid:28216127
41.Giraud A-L, Neumann K, Bachoud-Levi A-C, Wolff von Gudenberg A, Euler HA, Lanfermann H, et al. Severity of dysfluency correlates with basal ganglia activity in persistent developmental stuttering. Brain Lang. 2008;104:190–199. pmid:17531310
42.Sitek KR, Cai S, Beal DS, Perkell JS, Guenther FH, Ghosh SS. Decreased Cerebellar-Orbitofrontal Connectivity Correlates with Stuttering Severity: Whole-Brain Functional and Structural Connectivity Associations with Persistent Developmental Stuttering. Front Hum Neurosci. 2016;10:190. pmid:27199712
43.Frankford SA, Murray ESH, Masapollo M, Cai S, Tourville JA, Nieto-Castañón A, et al. The Neural Circuitry Underlying the “Rhythm Effect” in Stuttering. J Speech Lang Hear Res. 2021;64:2325–2346. pmid:33887150
44.Wu JC, Maguire G, Riley G, Lee A, Keator D, Tang C, et al. Increased dopamine activity associated with stuttering. Neuroreport. 1997;8:767–770. pmid:9106763
45.De Nil LF, Kroll RM, Houle S. Functional neuroimaging of cerebellar activation during single word reading and verb generation in stuttering and nonstuttering adults. Neurosci Lett. 2001;302:77–80. pmid:11290391
46.Neef NE, Bütfering C, Auer T, Metzger FL, Euler HA, Frahm J, et al. Altered morphology of the nucleus accumbens in persistent developmental stuttering. J Fluency Disord. 2018;55:84–93. pmid:28595893
47.Toyomura A, Fujii T, Yokosawa K, Kuriki S. Speech Disfluency-dependent Amygdala Activity in Adults Who Stutter: Neuroimaging of Interpersonal Communication in MRI Scanner Environment. Neuroscience. 2018;374:144–154. pmid:29378280
48.Neumann K, Euler HA, Kob M, Wolff von Gudenberg A, Giraud A-L, Weissgerber T, et al. Assisted and unassisted recession of functional anomalies associated with dysprosody in adults who stutter. J Fluency Disord. 2018;55:120–134. pmid:28958627
49.Connally EL, Ward D, Howell P, Watkins KE. Disrupted white matter in language and motor tracts in developmental stuttering. Brain Lang. 2014;131:25–35. pmid:23819900
50.Johnson CA, Liu Y, Waller N, Chang S-E. Tract profiles of the cerebellar peduncles in children who stutter. Brain Struct Funct. 2022;227:1773–1787. pmid:35220486
51.Neef NE, Anwander A, Bütfering C, Schmidt-Samoa C, Friederici AD, Paulus W, et al. Structural connectivity of right frontal hyperactive areas scales with stuttering severity. Brain. 2018;141:191–204. pmid:29228195
52.Kronfeld-Duenias V, Amir O, Ezrati-Vinacour R, Civier O, Ben-Shachar M. The frontal aslant tract underlies speech fluency in persistent developmental stuttering. Brain Struct Funct. 2016;221:365–381. pmid:25344925
53.Neef NE, Anwander A, Friederici AD. The Neurobiological Grounding of Persistent Stuttering: from Structure to Function. Curr Neurol Neurosci Rep. 2015;15:63. pmid:26228377
54.Connally EL, Ward D, Pliatsikas C, Finnegan S, Jenkinson M, Boyles R, et al. Separation of trait and state in stuttering. Hum Brain Mapp. 2018;39:3109–3126. pmid:29624772
55.Watkins KE, Chesters J, Connally EL. The neurobiology of developmental stuttering. In: Hickok G, Small S, editors. Neurobiology of Language. 2016. p. 995–1004. View ArticleGoogle Scholar
56.Budde KS, Barron DS, Fox PT. Stuttering, induced fluency, and natural fluency: A hierarchical series of activation likelihood estimation meta-analyses. Brain Lang. 2014;139:99–107. pmid:25463820
57.Chang S-E, Guenther FH. Involvement of the Cortico-Basal Ganglia-Thalamocortical Loop in Developmental Stuttering. Front Psychol. 2020;10:3088. pmid:32047456
58.Craig-McQuaide A, Akram H, Zrinzo L, Tripoliti E. A review of brain circuitries involved in stuttering. Front Hum Neurosci. 2014;8:884. pmid:25452719
59.Chang S-E, Garnett EO, Etchell A, Chow HM. Functional and Neuroanatomical Bases of Developmental Stuttering: Current Insights. Neurosci. 2019;25:566–582. pmid:30264661
60.Brainard MS, Doupe AJ. Translating Birdsong: Songbirds as a Model for Basic and Applied Medical Research. Annu Rev Neurosci. 2013;36:489–517. pmid:23750515
61.Nieder A, Mooney R. The neurobiology of innate, volitional and learned vocalizations in mammals and birds. Philos Trans R Soc B. 2020;375:20190054. pmid:31735150
62.Ziegler W, Ackermann H. Subcortical Contributions to Motor Speech: Phylogenetic, Developmental, Clinical. Trends Neurosci. 2017;40:458–468. pmid:28712469
63.Petkov CI, Jarvis ED. Birds, primates, and spoken language origins: behavioral phenotypes and neurobiological substrates. Front Evol Neurosci. 2012;4:12. pmid:22912615
64.Zhang YS, Ghazanfar AA. A Hierarchy of Autonomous Systems for Vocal Production. Trends Neurosci. 2020;43:115–126. pmid:31955902
65.Meier AM, Guenther FH. Neurocomputational modeling of speech motor development. J Child Lang. 2023;1–18. pmid:37337871
66.Hull C. The cerebellum influences vocal timing. eLife. 2018;7:e40447. pmid:30152753
67.Simmonds AJ, Leech R, Iverson P, Wise RJS. The response of the anterior striatum during adult human vocal learning. J Neurophysiol. 2014;112:792–801. pmid:24805076
68.Jürgens U. The Neural Control of Vocalization in Mammals: A Review. J Voice. 2009;23:1–10. pmid:18207362
69.Hage SR, Gavrilov N, Nieder A. Cognitive Control of Distinct Vocalizations in Rhesus Monkeys. J Cognitive Neurosci. 2013;25:1692–1701. pmid:23691983
70.Loh KK, Procyk E, Neveu R, Lamberton F, Hopkins WD, Petrides M, et al. Cognitive control of orofacial motor and vocal responses in the ventrolateral and dorsomedial human frontal cortex. Proc National Acad Sci U S A. 2020;117:4994–5005. pmid:32060124
71.Jürgens U. The role of the periaqueductal grey in vocal behaviour. Behav Brain Res. 1994;62:107–117. pmid:7945960
72.Jürgens U, von Cramon D. On the role of the anterior cingulate cortex in phonation: A case report. Brain Lang. 1982;15:234–248. pmid:7074343
73.Tschida K, Michael V, Takatoh J, Han B-X, Zhao S, Sakurai K, et al. A Specialized Neural Circuit Gates Social Vocalizations in the Mouse. Neuron. 2019;103:459–472.e4. pmid:31204083
74.Gloveli N, Simonnet J, Tang W, Concha-Miranda M, Maier E, Dvorzhak A, et al. Play and tickling responses map to the lateral columns of the rat periaqueductal gray. Neuron. 2023. pmid:37516112
75.Gerbella M, Pinardi C, Cesare GD, Rizzolatti G, Caruana F. Two Neural Networks for Laughter: A Tractography Study. Cereb Cortex. 2020;31:899–916. pmid:32969467
76.Garnett EO, Chow HM, Nieto-Castañón A, Tourville JA, Guenther FH, Chang S-E. Anomalous morphology in left hemisphere motor and premotor cortex of children who stutter. Brain. 2018;141:2670–2684. pmid:30084910
77.Chow HM, Garnett EO, Koenraads SPC, Chang S-E. Brain developmental trajectories associated with childhood stuttering persistence and recovery. Dev Cogn Neurosci. 2023;60:101224. pmid:36863188
78.Chang S-E, Zhu DC, Choo AL, Angstadt M. White matter neuroanatomical differences in young children who stutter. Brain. 2015;138:694–711. pmid:25619509
79.Chow HM, Chang S. White matter developmental trajectories associated with persistence and recovery of childhood stuttering. Hum Brain Mapp. 2017;38:3345–3359. pmid:28390149
80.Neef NE, Angstadt M, Koenraads SPC, Chang S-E. Dissecting structural connectivity of the left and right inferior frontal cortex in children who stutter. Cereb Cortex. 2022. pmid:36057839
81.Chow HM, Garnett EO, Ratner NB, Chang S-E. Brain activity during the preparation and production of spontaneous speech in children with persistent stuttering. NeuroImage Clin. 2023;38:103413. pmid:37099876
82.Chang S-E, Angstadt M, Chow HM, Etchell AC, Garnett EO, Choo AL, et al. Anomalous network architecture of the resting brain in children who stutter. J Fluency Disord. 2018;55:46–67. pmid:28214015
83.Belyk M, Kraft SJ, Brown S. Stuttering as a trait or state–an ALE meta-analysis of neuroimaging studies. Eur J Neurosci. 2015;41:275–284. pmid:25350867
84.Braun AR, Varga M, Stager S, Schulz G, Selbie S, Maisog JM, et al. Altered patterns of cerebral activity during speech and language production in developmental stuttering. An H2(15)O positron emission tomography study. Brain. 1997;120:761–784. pmid:9183248
85.Neef NE, Bütfering C, Anwander A, Friederici AD, Paulus W, Sommer M. Left posterior-dorsal area 44 couples with parietal areas to promote speech fluency, while right area 44 activity promotes the stopping of motor responses. Neuroimage. 2016;142:628–644. pmid:27542724
86.Chang S-E, Kenney MK, Loucks TMJ, Ludlow CL. Brain activation abnormalities during speech and non-speech in stuttering speakers. Neuroimage. 2009;46:201–212. pmid:19401143
87.Cai S, Tourville JA, Beal DS, Perkell JS, Guenther FH, Ghosh SS. Diffusion imaging of cerebral white matter in persons who stutter: evidence for network-level anomalies. Front Hum Neurosci. 2014;8:54. pmid:24611042
88.Qiao J, Wang Z, Zhao G, Huo Y, Herder CL, Sikora CO, et al. Functional neural circuits that underlie developmental stuttering. PLoS ONE. 2017;12:e0179255. pmid:28759567
89.Chang S-E, Zhu DC. Neural network connectivity differences in children who stutter. Brain. 2013;136:3709–3726. pmid:24131593